Crédits photos : ScenTree SAS
| Entreprise | Nom de l'ingrédient | ID | Commentaires | Naturalité | Certifications | MOQ | Pureté |
|---|---|---|---|---|---|---|---|
|
|
MATSUNOL™ | 939788 |
Visit website
|
Molecules |


|
- | - |
|
|
Ebanol® - 30gr | - |
Visit website
|
- | - | - | |
|
|
EPANOL | - |
Visit website
|
- | 10 grs | - |
Général
-
N° CAS :
67801-20-1 -
N° EINECS :
267-140-4 -
N° FEMA :
4775 -
N° FLAVIS :
Donnée indisponible.
-
N° JECFA :
2220 -
Tenue :
Fond -
Gamme de prix :
€€
Propriétés physico-chimiques
-
Aspect :
Liquide incolore -
Densité :
0,9 -
Indice de réfraction :
Data not available. -
Pouvoir rotatoire :
Data not available. -
Pression de vapeur :
Data not available. -
Point éclair :
108°C (226,4°F)
-
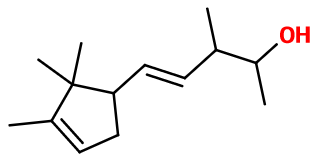
Formule brute :
C14H24O -
Masse molaire :
208,34 g/mol -
Log P :
4,9 -
Point de fusion :
< -50°C (< -58°F) -
Point d'ébullition :
283°C (541,4°F) -
Seuil de détection :
Donnée indisponible.
Chimie & usages
Usages en parfumerie :
L'Ebanol® est utilisé pour apporter du volume et de l'élégance aux accords boisés, et un effet caractéristique, diffusif, de bois de santal. Il apporte une grande tenue à ses parfums.
Découverte :
1986
Présence dans la nature :
L'Ebanol® n'est pas présent dans la nature. Il ne peut donc pas être extrait d'une quelconque plante.
Isoméries :
L'Ebanol® est un mélange de quatre principaux diastéréosiomères. Ceux-ci appraissent lors de la synthèse du composé et sont dûs à la présence de trois carbones asymériques et une double liaison susceptible de donner naissance à des stéréosiomères. Parmi ces isomères, on compte le trans-(E)-Ebanol® et le cis-(Z)-Ebanol®. C'est donc un mélange de ces isomères qui est utilisé en parfumerie.
Précurseurs de synthèse :
L'Ebanol® n'est pas précurseur de la synthèse d'un autre composé d'intérêt olfactif.
Voies de synthèse :
L'Ebanol® peut être obtenu en trois étapes. La première est une condensation du Campholènaldéhyde avec la 2-butanone. L'intermédiaire obtenu est alors isomérisé en y ajoutant du tert-butylate de potassium dilué dans un solvant comme le diméthyl formamide. Le dernière étape est une réduction du produit obtenu par le tétrahydruroborate de sodium, amenant à l'obtention de quatre stéréosiomères (voir paragraphe ''Isomérie '').
Stabilité :
Stable en eau de toilette et dans des bases diverses, hors bases très acides (détergents, déodorants) et très basiques (détergents, javel)
Commentaires et anecdotes :
La structure de l'Ebanol® rappelle fortement celle du Sandalore®. Le Sandalore® ne possède simplement pas la double liaison carbone-carbone qui mène l'Ebanol® à être un mélange d'isomères. Le thème olfactif des molécules empruntant ce modèle de structure est globalement le même : Le Bacdanol®, le Polysantol® et le Javanol® ont tous les trois aussi des notes de bois de santal.
IFRA
51ème amendement :
Cet ingrédient n'est pas réglementé par le 51ème amendement

















